질산 납(II)
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
질산 납(II)는 화학식 Pb(NO₃)₂를 갖는 무색 결정성 화합물이다. 1597년 안드레아스 리바비우스에 의해 처음 확인되었으며, 금속 납과 농축 질산의 반응으로 상업적으로 생산된다. 질산 납(II)는 크롬 옐로우, 크롬 오렌지, 나폴리 옐로우와 같은 안료, 흑색 화약의 산화제, 특수 폭발물, 나일론과 폴리에스터의 열 안정제, 쥐약 등에 사용된다. 고체 질산 납(II)는 면심 입방 격자를 이루는 입방정계로 결정화되며, 물에 잘 녹아 불용성 납 염을 합성하는 데 사용된다. 질산 납(II)은 독성이 있어 섭취 시 급성 납 중독을 일으킬 수 있으며, 국제 암 연구 기구(IARC)에 의해 인간에게 발암 가능성이 있는 물질로 분류된다.
더 읽어볼만한 페이지
- 납(II) 화합물 - 납유리
납유리는 산화납을 첨가하여 제조하는 유리로, 높은 굴절률과 밀도, 낮은 점성, 특유의 음향적 특성을 지니지만, 납의 유해성으로 사용이 제한되고 있으며, 친환경 대체재가 개발되고 있다. - 납(II) 화합물 - 백연 (화합물)
백연은 납의 탄산염으로, 유화용 안료로 사용되었으며 건조성과 접착력이 우수하지만 독성이 있고 황 화합물과 혼합 시 흑변하는 특성을 가진 화합물이다. - 질산염 - 질산 나트륨
질산 나트륨은 화학식 NaNO3의 무기 화합물로, 비료, 산화제, 폭약 성분 등으로 사용되며, 조해성이 있고 물에 잘 녹으며, 식품 첨가물로 사용될 경우 발암성 물질 생성과 관련될 수 있다. - 질산염 - 질산 암모늄
질산 암모늄은 질산과 암모니아의 반응으로 만들어지는 염으로, 질소 비료와 폭약의 재료로 사용되며, 물에 용해될 때 흡열 반응을 일으키는 특성이 있지만 가열되거나 특정 조건에서는 폭발할 수 있어 안전 관리가 중요하다. - IARC 2A군 발암 물질 - 폴리염화 바이페닐
폴리염화바이페닐(PCB)은 바이페닐 분자의 수소 원자가 염소 원자로 치환된 유기 화합물 혼합물로, 뛰어난 특성으로 과거 널리 사용되었으나, 환경 및 인체 유해성으로 현재는 생산과 사용이 금지되었으며, 오염 제거 및 관리가 주요 과제이다. - IARC 2A군 발암 물질 - 글리포세이트
글리포세이트는 광범위하게 사용되는 제초제의 활성 성분으로, 농업, 임업 등 다양한 분야에서 활용되지만, 장기적인 환경 및 건강 영향에 대한 우려와 안전성 논란, 저항성 잡초 문제로 사용 규제 논의가 지속되고 있다.
2. 역사
질산 납(II)은 1597년 연금술사 안드레아스 리바비우스에 의해 처음 확인되었으며, 그는 이 물질의 단맛 때문에 "달콤한 납"이라는 뜻의 plumbum dulce|플룸붐 둘케la라고 불렀다.[5] 이후 금속 납과 농축된 질산의 반응을 통해 상업적으로 생산되기 시작했다.[6][7]
질산 납(II)는 산화 납(II)와 농축된 질산의 반응으로 생성된다.[10]
질산 납(II)은 가열하면 삐걱거리는 소리를 내며 분해되어 산화 납(II)를 생성한다. 이 특성은 불꽃놀이와 같은 화공술에 응용된다.[9] 질산 납(II)는 물과 묽은 질산에 잘 녹는다.[16]
과거에는 크롬 옐로우(크롬산 납(II), PbCrO4), 크롬 오렌지(염기성 크롬산 납(II), Pb2CrO5), 나폴리 옐로우와 같은 안료의 원료로 주로 사용되었다. 이러한 안료는 염색이나 캘리코 같은 직물의 인쇄에도 활용되었다.[8] 또한 흑색 화약의 산화제로 사용되기도 했으며, 아자이드화 납과 함께 특수 폭발물 제조에도 이용되었다.[9]
3. 생산
: PbO + 2 HNO3(농축) → Pb(NO3)2↓ + H2O
또한 금속 납과 희석된 질산을 반응시켜 얻은 용액을 증발시켜 얻을 수도 있다.[11]
: Pb + 4 HNO3 → Pb(NO3)2 + 2 NO2 + 2 H2O
: 또는 다른 조건에서는 다음과 같은 반응이 일어난다:
: Pb + 8 HNO3 → 3 Pb(NO3)2 + 2 NO + 4 H2O
질산 납(II)의 용액과 결정은 납 제련소에서 납–비스무트 폐기물을 처리하는 과정에서 부산물로 형성되기도 한다.[12]
이 외에도 금속 납 또는 산화 납(II)을 가열하여 질산에 녹인 후, 뜨거운 물에서 재결정화하는 방법으로도 얻을 수 있다. 공업적인 규모에서의 합성법은 알려져 있지 않다.
4. 구조
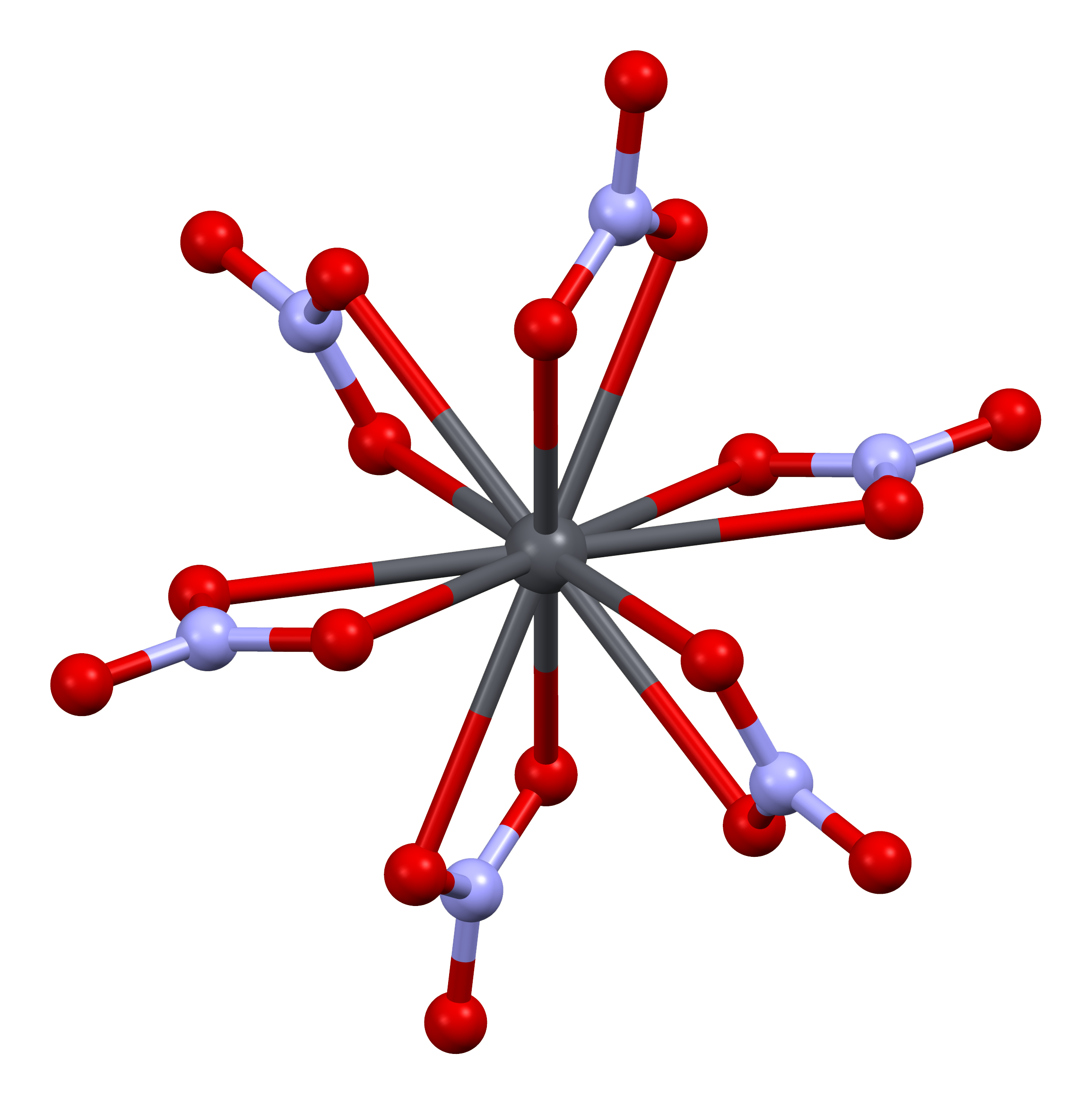
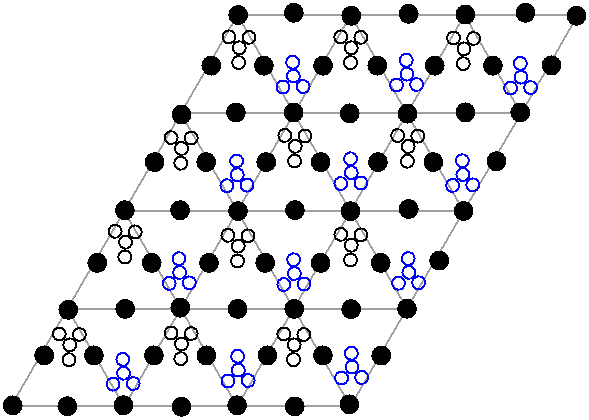
고체 질산 납(II)의 결정 구조는 중성자 회절을 통해 결정되었다.[13][14] 이 화합물은 납(Pb) 원자가 면심 입방 격자를 이루며 입방정계로 결정화된다. 공간군은 Pa3Z=4 (브라베 격자 표기법)이며, 각 입방체의 변 길이는 784pm이다.
결정 구조 내에서 검은색 점은 납 원자를 나타내고, 흰색 점은 납 원자 평면 위 27pm에 위치한 질산기를, 파란색 점은 이 평면 아래 같은 거리에 있는 질산기를 보여준다. 이 배열에서 모든 납 원자는 12개의 산소(O) 원자와 배위 결합을 형성하며, 결합 길이는 281pm이다. 모든 질소(N)–산소(O) 결합 길이는 127pm로 동일하다.[15]
질산 납(II)의 결정 구조에 대한 연구는 부분적으로 고온에서 결정 격자 내 질산기의 자유로운 내부 회전 가능성에 대한 관심에서 비롯되었으나, 실제로는 이러한 회전이 일어나지 않는 것으로 밝혀졌다.[14]
5. 화학적 성질 및 반응
알칼리를 용액에 첨가하면 염기성 질산염이 형성된다. 용액의 pH가 낮을 때는 주로 Pb2(OH)2(NO3)2가 생성되며, pH가 높아지면 Pb6(OH)5(NO3)가 형성된다.[17] 또한 Pb(NO3)OH나 Pb3O(OH)2(NO3)2와 같은 염기성 염도 알려져 있다. 특히, [Pb6O(OH)6]4+ 양이온은 세 개의 면을 공유하는 PbO4 사면체 클러스터 내부에 산화물 이온(O2-)을 포함하는 독특한 구조를 가진다.[18] 일반적인 조건(pH 12 미만)의 수용액에서는 수산화 납(II)(Pb(OH)2)이 형성된다는 뚜렷한 증거는 없다.
질산 납(II) 용액은 다양한 배위 복합체를 형성하는 데 사용될 수 있다. HSAB 이론에 따르면, 납(II) 이온은 '경성 산'으로 분류되며, 전자를 제공하는 질소나 산소 원자를 포함하는 리간드와 더 강한 결합을 형성하는 경향이 있다. 예를 들어, 질산 납(II)과 펜타에틸렌 글라이콜(EO5)을 아세토니트릴과 메탄올 혼합 용액에서 반응시킨 후 천천히 증발시키면 [Pb(NO3)2(EO5)] 화합물이 생성된다.[19] 이 화합물의 결정 구조를 보면, EO5 사슬이 마치 왕관 에테르처럼 납 이온의 적도면 주위를 둘러싸고 있으며, 두 개의 두 자리 질산염 리간드는 서로 반대편에 위치하는 트랜스 배위를 하고 있다. 이 복합체에서 납 이온의 총 배위수는 10이며, 양쪽으로 모자가 씌워진 정사각형 반각기둥 분자 구조를 가진다.
비티아졸 두 자리 N-주개 리간드와 형성하는 복합체는 두 개의 납 원자를 포함하는 이핵성 구조를 가질 수 있다. 결정 구조는 질산염 그룹이 두 개의 납 원자 사이의 다리를 형성함을 보여준다.[20] 이러한 유형의 복합체의 한 가지 흥미로운 측면은 배위권에 물리적 간극이 존재한다는 점이다. 즉, 리간드가 금속 이온 주위에 대칭적으로 배치되지 않는다. 이는 납 고립 전자쌍 때문일 수 있으며, 이미다졸 리간드를 갖는 납 복합체에서도 발견된다.[21]
다른 납 염과 달리 질산 납(II)는 물에 잘 녹기 때문에, 물에 잘 녹지 않는 다양한 납 화합물을 합성할 때 좋은 출발 물질로 사용된다.
5. 1. 침전 반응
질산 납(II) 수용액과 요오드화 칼륨(KI) 수용액은 각각 무색 투명하지만, 두 용액을 섞으면 선명한 노란색을 띠는 요오드화 납(II) 침전이 생성된다. 이 반응은 시각적으로 인상적이어서, 화학 교육에서 침전 현상을 보여주는 시연 실험으로 자주 활용된다.
반응식은 다음과 같다:
Pb(NO3)2(aq) + 2KI(aq) → PbI2(s)↓ + 2KNO3(aq)
다른 납 염과 달리 질산 납(II)는 물에 잘 녹기 때문에, 물에 잘 녹지 않는 다양한 납 화합물을 합성할 때 좋은 출발 물질로 사용된다.
6. 용도
과거에는 크롬 옐로우(크롬산 납(II), PbCrO4), 크롬 오렌지(염기성 크롬산 납(II), Pb2CrO5), 나폴리 옐로우와 같은 안료를 만드는 원료로 사용되었다. 이 안료들은 염색이나 캘리코(calico) 같은 직물을 인쇄하는 데 쓰였다.[8] 또한 흑색 화약의 산화제나 아자이드화 납과 같은 특수 폭발물 제조에도 이용되었다.[9]
현재는 나일론과 폴리에스터의 열 안정제, 감열지 코팅, 쥐약 등에 사용된다.[10] 성냥 제조나 날염 시 매염제로도 쓰이며, 다른 납 화합물을 합성하는 원료가 되기도 한다.
금의 청화법(추출법의 일종)으로 침출하는 금 시안화 공정에서 질산 납(II) 용액을 소량(금 1kg당 질산 납 10~100mg) 첨가하면 침출(leaching) 공정을 개선하는 효과가 있다. 특히 부분적으로 산화된 광석에 효과적이다.[22][23]
유기 화학에서는 디티오카르바메이트로부터 아이소싸이오사이안산염을 제조하는 데 사용될 수 있으며,[24] SN1 치환 반응 중 브로민 제거제로 사용된 사례도 보고되었다.[25]
질산 납(II)을 가열하면 이산화 질소를 쉽게 얻을 수 있다.
:
7. 안전성
질산 납(II)는 독성이 있으며, 섭취 시 급성 납 중독을 일으킬 수 있는데, 이는 모든 가용성 납 화합물에 해당한다.[26] 모든 무기 납 화합물은 국제 암 연구 기구(IARC)에 의해 인간에게 발암 가능성이 있는 물질 (그룹 2A)로 분류된다.[27] 이는 실험 동물에서 신장암 및 신경교종과 연관성이 나타났으며, 인체에서는 신장암, 뇌암 및 폐암과의 관련성이 제기되고 있다. 다만, 납에 노출된 작업자에 대한 연구는 종종 비소와 같은 다른 유해 물질에 동시에 노출되는 경우가 많아 해석에 어려움이 있다.[28]
납은 체내에서 효소를 포함한 여러 생체 분자의 정상적인 기능을 방해할 수 있다. 특히 필수 미네랄인 아연 대신 결합하여 효소의 활성을 저해하는 것으로 알려져 있다. 예를 들어, 혈액 생합성 과정에 중요한 역할을 하는 δ-아미노레불린산 탈수 효소나 DNA 대사에 관여하는 피리미딘-5′-뉴클레오티데이스와 같은 효소의 기능이 납에 의해 방해받을 수 있다. 이러한 생화학적 교란은 특히 발달 중인 태아에게 심각한 손상을 유발할 수 있어 각별한 주의가 필요하다.[29]
금속 납이나 황화납과 같이 물에 잘 녹지 않는 납 화합물은 상대적으로 위험성이 낮다고 여겨지기도 하지만, 염화 납(II)와 같이 물에 잘 녹거나 질산 납(II)처럼 용해도가 낮은 경우에도 체내 흡수 시 납 중독을 일으킬 수 있다. 납 중독의 주요 증상으로는 장 기능 부전, 복부의 극심한 통증, 식욕 감퇴, 메스꺼움, 구토 등이 나타날 수 있다. 따라서 질산 납(II)을 사용하거나 취급할 때는 반드시 적절한 보호 장비를 착용하고 안전 수칙을 준수해야 한다.
참조
[1]
서적
Handbook of inorganic chemicals
https://www.worldcat[...]
McGraw-Hill
2003
[2]
서적
CRC handbook of chemistry and physics : a ready-reference book of chemical and physical data.
https://www.worldcat[...]
2016
[3]
웹사이트
Lead nitrate
https://pubchem.ncbi[...]
2021-12-19
[4]
문서
Lead compounds (as Pb)
[5]
서적
Alchemia Andreæ Libavii
Iohannes Saurius
[6]
EB1911
[7]
서적
Progress of America to year 1846
Whittaker & Co
[8]
서적
A Text-book of Inorganic Chemistry
MacMillan
[9]
간행물
Lead nitrate as an oxidizer in blackpowder
Pyrotechnica Publications
1978-10
[10]
서적
Chemistry of the Elements
https://archive.org/[...]
Butterworth-Heinemann
[11]
서적
Kirk-Othmer Encyclopedia of Chemical Technology
John Wiley & Sons
[12]
웹사이트
Product catalog; other products
http://www.sidech.be[...]
Sidech
2008-01-05
[13]
간행물
A neutron crystallographic study of lead nitrate
[14]
간행물
Structure refinement of lead nitrate
[15]
간행물
Cấu trúc của chì nitrat
https://scripts.iucr[...]
1986-02-15
[16]
간행물
Lead nitrate—Nitric acid—Water system
[17]
간행물
Basic Salts of Lead Nitrate Formed in Aqueous Media
[18]
문서
p. 395
[19]
간행물
Structural Chemistry of Poly (ethylene glycol). Complexes of Lead(II) Nitrate and Lead(II) Bromide
[20]
간행물
A Dimeric Mixed-Anions Lead(II) Complex: Synthesis and Structural Characterization of [Pb2(BTZ)4(NO3)(H2O)](ClO4)3 {BTZ = 4,4'-Bithiazole}
[21]
간행물
2D 4.82 Network with threefold parallel interpenetration from nanometre-sized tripodal ligand and lead(II) nitrate
[22]
간행물
Recent advances in gold metallurgy
[23]
웹사이트
Auxiliary agents in gold cyanidation
http://www.e-goldpro[...]
Gold Prospecting and Gold Mining
2008-01-05
[24]
OrgSynth
Phenyl isothiocyanate
[25]
OrgSynth
(S)-N-(9-Phenylfluoren-9-yl)alanine and (S)-Dimethyl-N-(9-phenylfluoren-9-yl)aspartate
[26]
웹사이트
Lead nitrate, Chemical Safety Card 1000
http://www.inchem.or[...]
International Labour Organization, International Occupational Safety and Health Information Centre
1999-03
[27]
간행물
Inorganic and Organic Lead Compounds
http://monographs.ia[...]
International Agency for Research on Cancer
2008-01-19
[28]
간행물
Inorganic and Organic Lead Compounds
http://monographs.ia[...]
International Agency for Research on Cancer
2008-01-01
[29]
간행물
Erythrocyte pyrimidine 5'-nucleotidase activity in workers exposed to lead, mercury or cadmium
[30]
서적
Handbook of inorganic chemicals
https://www.worldcat[...]
McGraw-Hill
2003
[31]
서적
CRC handbook of chemistry and physics : a ready-reference book of chemical and physical data.
https://www.worldcat[...]
2016
[32]
웹인용
Lead nitrate
https://pubchem.ncbi[...]
2021-12-19
[33]
문서
Lead compounds (as Pb)
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
